Endocrinologie du Diabète et de la Fertilité
Le système endocrinien joue un rôle crucial dans le maintien de l’homéostasie corporelle, et son dysfonctionnement peut perturber des fonctions physiologiques essentielles. Les recherches menées par l’équipe EnDF visent à mieux comprendre les systèmes endocriniens impliqués dans la régulation du glucose et la fonction de reproduction, en particulier le pancréas endocrine et l’axe hypothalamo-hypophyso-ovarien (HPO). Notre objectif est d’analyser la physiologie de ces systèmes complexes, d’étudier leurs interrelations, et d’identifier les facteurs environnementaux ou endogènes susceptibles d’altérer leur fonctionnement, ce qui peut entraîner des pathologies telles que le diabète et l’infertilité.
En 2025, les équipes Biologie et Pathologie du Pancréas Endocrine (B2PE) et Physiologie de l’Axe Gonadotrope (PAG) ont fusionné pour créer une nouvelle équipe nommée “Endocrinologie du Diabète et de la Fertilité” (EnDF). L’équipe EnDF est organisée en deux groupes : le premier axé sur le pancréas endocrine et le deuxième sur l’axe gonadotrope. En plus, de la poursuite de projets spécifiques aux 2 groupes, l’équipe EnDF travaille en étroite collaboration, en développant des projets transversaux innovants pour étudier la relation bidirectionnelle entre le diabète et la fertilité, qui est devenue un enjeu majeur dans nos sociétés industrialisées.
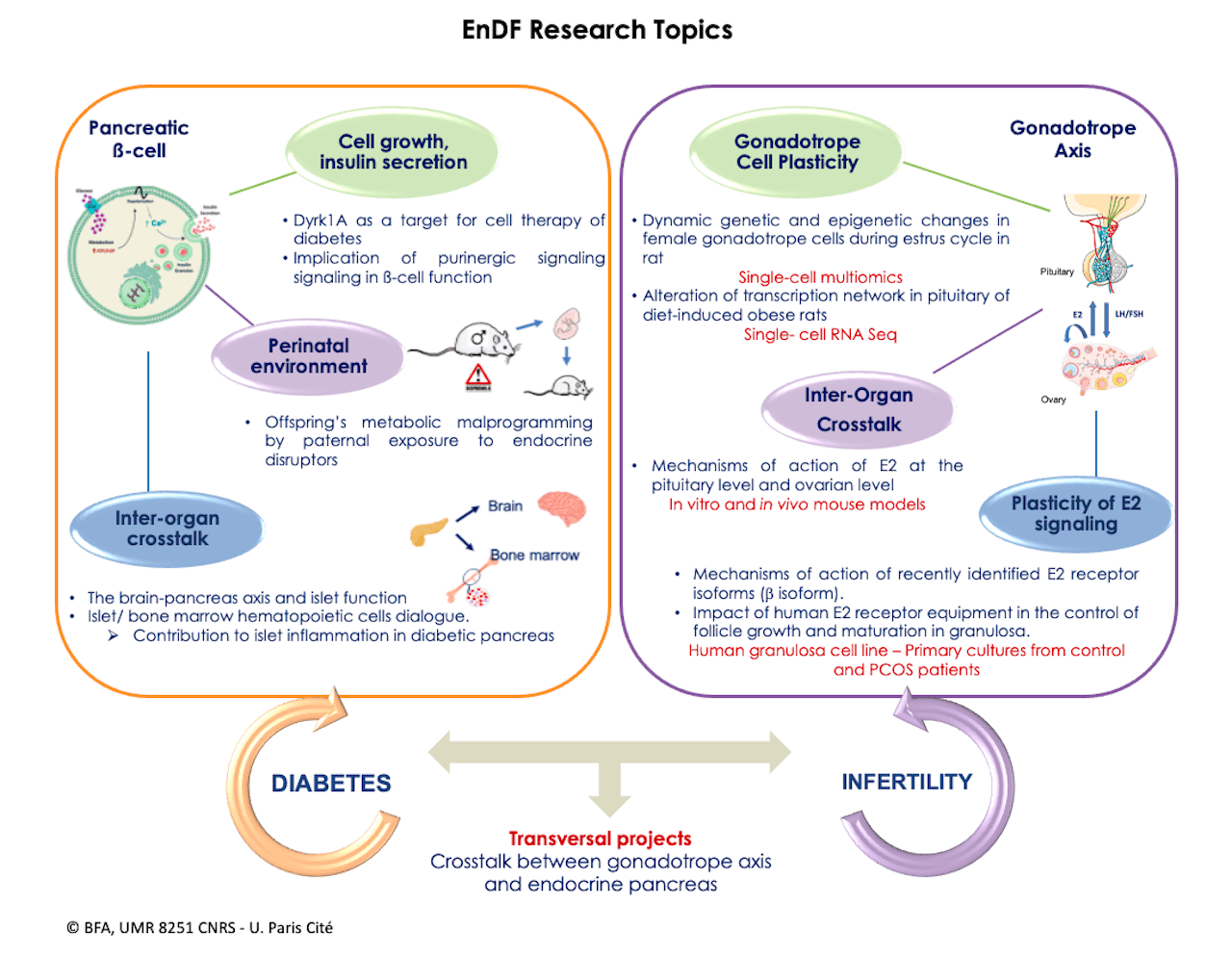
Axes de Recherche
Axes thématiques du pancréas endocrine
Mécanismes moléculaires de la croissance et de la fonction des cellules β. Aspects physiologiques et pathologiques.
- Induction de la prolifération et de la différenciation des cellules β du pancréas par la modulation de l’activité de la kinase Dyrk1A
Des études convaincantes sur le pancréas humain ont démontré, qu’à un stade avancé du diabète de type 2 (DT2), la masse des cellules β diminue significativement en raison de la diminution de leur prolifération et de l’augmentation de leur apoptose, probablement causées par la gluco- et la lipotoxicité. Cette perte de cellules β contribue à une sécrétion d’insuline inadéquate, un aspect central du développement du DT2. Pour contrer ce phénomène, la régénération des cellules β et la préservation des îlots de Langerhans sont considérées comme des stratégies thérapeutiques potentielles. En ligne avec nos activités de longue date pour l’identification de cibles moléculaires pour la stimulation de la régénération des cellules β, et dans la continuité de nos précédents travaux sur GSK3β (Figeac et al. 2010, Am J Physiol Metab, 2010 ; Figeac et al. Mol Ther 2012 ; Pitasi et al. J Endocrinol, 2020),nous avons orienté nos recherches vers Dyrk1A, une enzyme en interaction étroite avec GSK3β. En partenariat avec la société de biotechnologie Perha Pharmaceuticals, des inhibiteurs de Dyrk1A sont testés sur des modèles animaux (rats diabétiques GK et souris db/db). Ces études visent à étudier les effets des inhibiteurs sur la régénération des cellules β et à identifier les voies de signalisation impliquées. Les résultats pourraient conduire au développement de nouvelles thérapies pour préserver la fonction des cellules β et restaurer leur masse dans le DT2.
Movassat (PI), B. Uzan (PI), S. Tolu, D.Picot. Collaborations: L. Meijer (Perha Pharmaceuticals), J. Dairou (LCBPT, UMR 8601), P. Cattan (Hôp. Saint-Louis, Paris 10). Financements: Eurostars 2021, ANR PRCE 2022.
- Impact du microenvironnement sur la régulation de la fonctionnalité des cellules ß saines et diabétiques.
Plusieurs études expérimentales ou cliniques ont signalé des altérations structurelles et fonctionnelles de la micro-vascularisation des îlots de rongeurs ou humains au cours des pathologies diabétiques. Cette perte des échanges entre les cellules ß et la circulation serait un facteur clé dans le dysfonctionnement des cellules ß et la perte de régulation de la réponse au glucose qui caractérise le DT2. Une des conséquences glucotoxiques de l’hyperglycémie chronique serait une production excessive d’ATP conduisant à l’activation accrue de la signalisation purinergique de type P2. La littérature indique un rôle de ce type de récepteurs (P2X) dans la modulation délétère de différents tissus (tissu adipeux et cellules nerveuses) ainsi que dans la micro-vascularisation rétinienne et rénale dans des modèles animaux de DT2. Dans la poursuite de nos travaux précédents (Quinault et al. Biochem Biophys Acta, 2016 ; Mesto et al. J Cell Physiol, 2022), notre travail vise à mieux comprendre l’impact éventuel de la signalisation purinergique qui affecterait les interactions entre les cellules ß et les cellules endothéliales dans l’îlot de Langherans dans un environnement glucotoxique (comme le DT2).
C. Tourrel-Cuzin (PI), B. Uzan, S. Tolu, J. Movassat, D. Picot.
- Perturbation de l’hématopoïèse et infiltration de cellules immunitaires dans les îlots de Langerhans au cours du diabète
La moelle osseuse MO est le site principal de production des cellules sanguines et contient des cellules souches et progénitrices hématopoïétiques (HSPC). Il est connu que l’obésité provoque une inflammation chronique dans le tissu adipeux, ce qui stimule la prolifération des HSPC et augmente la production de cellules myéloïdes. Cependant, les impacts du diabète sans obésité sur l’hématopoïèse n’ont pas encore été étudiés. En tirant partie du modèle de DT2, le rat Goto-Kakizaki (GK), qui reproduit la perte de cellules β et l’inflammation des îlots présents chez les patients diabétiques, l’objectif est de caractériser les phénotypes hématopoïétiques dans la MO et le sang des rats GK à différents stades de la maladie (prédiabétiques et diabétiques confirmés). En outre, nous cherchons à comprendre comment le diabète affecte l’hématopoïèse et comment une population perturbée de cellules de la MO pourrait influencer l’inflammation des îlots de Langerhans et le dysfonctionnement des cellules β dans le pancréas (transplantations de MO entre rats GK et rats Wistar (sains). Par la suite, des voies moléculaires modifiées dans les populations hématopoïétiques des rats GK à différents stades de la maladie, seront analysées pour mieux comprendre les mécanismes sous-jacents de ces anomalies.
B. Uzan (PI), C. Tourrel-Cuzin, J. Movassat, D. Picot, S. Tolu.
Programmation environnementale des maladies métaboliques
La prise de conscience générale de l’impact de l’environnement nutritionnel et toxicologique maternel sur la santé de la progéniture s’est considérablement accrue dans nos sociétés au cours des dernières décennies (Portha et al. Nutrients, 2019). Cependant, l’héritage environnemental (transmission non génétique) des maladies, à travers la lignée paternelle, reste sous-exploré. Nous avons récemment développé de nouveaux projets sur ce sujet émergent et montré que l’alimentation paternelle riche en protéines modifie la sensibilité à l’insuline de leur progéniture de manière dépendante du sexe (Gong et al. Biomolecules, 2021). Dans le prolongement de nos recherches dans ce domaine, nous développons un projet pour comprendre le rôle de l’environnement toxicologique, afin de répondre aux préoccupations sociétales actuelles liées à l’exposition généralisée aux polluants environnementaux (perturbateurs endocriniens, pollution de l’air). Nous étudions l’impact de l’exposition paternelle pré-conceptionnelle aux perturbateurs endocriniens sur la santé métabolique de la progéniture. Nous étudions le profil de petits ARN non codants dans le sperme des géniteurs mâles exposés au BPS, ainsi que les modifications épigénétiques survenant dans les tissus pancréatiques, musculaires, hépatiques et adipeux de leur progéniture fœtale et adulte (Collaboration avec le Dr Valérie Grandjean),. Cette étude fournira des preuves supplémentaires que les changements de l’environnement paternel avant la conception pourraient avoir un impact significatif sur la santé métabolique de leur progéniture à l’âge adulte.
J. Movassat (PI), D. L’Hôte, B. Uzan, C. Tourrel-Cuzin, D. Picot, S. Tolu. Collaborations : V. Grandjean (C3M – Inserm U1065). Financement:Société Francophone du Diabète
Le lien entre le DT2 et les maladies neurodégénératives. L’axe îlot/cerveau.
Les données épidémiologiques suggèrent un risque accru de développer la maladie d’Alzheimer (MA) chez les personnes atteintes de DT2.). Avec le vieillissement de la population, on s’attend à ce que le fardeau socio-économique et humain de ces maladies augmente considérablement. Malgré le grand nombre de preuves épidémiologiques établissant un lien entre la MA et le DT2, les mécanismes moléculaires qui sous-tendent cette association sont encore inconnus. En collaboration avec le Dr N Janel (BFA, équipe 1), nous avons récemment démontré que le rat GK diabétique présente plusieurs marqueurs circulants de type Alzheimer (Movassat et al. Front Neurol, 2019). Nous allons maintenant analyser certaines des caractéristiques cérébrales et pancréatiques reliant le T2D aux maladies neurodégénératives, en collaboration avec le Dr N. Janel et le Dr J. Dairou (LCBPT, UMR 8601). L’identification de mécanismes moléculaires partagés entre la MA et le DT2 est cruciale car elle pourrait conduire à l’identification de cibles thérapeutiques communes pour le traitement de ces deux maladies interconnectées.
Movassat (PI), S. Tolu, B. Uzan, C. Tourrel-Cuzin, D. Picot. Collaborations : N. Janel (BFA, Equipe 1), J. Dairou (LCBPT, CNRS UMR 8601).
Axes Thématiques sur l’axe gonadotrope
Plasticité moléculaire dans la régulation hypophysaire de la fonction reproductive.
Chez les mammifères, l’hypophyse intègre de multiples signaux, produits localement ou émanant du système nerveux central et de la périphérie, pour contrôler de manière appropriée l’activité gonadique au cours des principales phases de la vie reproductive. Il en résulte une grande plasticité de l’activité des cellules gonadotropes de l’hypophyse, qui culmine chez les femelles pendant le cycle de l’œstrus, caractérisé par une sécrétion finement ajustée des deux gonadotrophines, la LH et la FSH. Il est surprenant de constater que les mécanismes moléculaires qui sous-tendent cette plasticité sont encore mal compris. En outre, l’activité hypophysaire est également ciblée par des signaux liés à la nutrition, notamment les acides gras (Garrel et al. Endocrinology 2011 ; Garrel et al. Endocrinology 2014). En conséquence, nous avons récemment rapporté une altération de l’activité gonadotrope chez des rats nourris avec un régime riche en graisses (HFD) à court ou à long terme. Il est intéressant de noter que, bien que la suralimentation soit connue pour activer les voies inflammatoires dans plusieurs tissus métaboliques ainsi que dans l’hypothalamus, ce qui contribue aux troubles métaboliques, aucune augmentation de l’expression génétique des médiateurs inflammatoires n’a pu être détectée dans l’hypophyse (Garrel et al. Front Endocrinol 2022). En outre, les gonadotrophines étaient les seules hormones hypophysaires encore affectées chez les rats nourris avec un régime alimentaire riche à long terme, ce qui souligne une susceptibilité différentielle des différentes lignées hypophysaires aux troubles métaboliques. Notre projet consiste à utiliser les technologies de pointe de la cellule unique (sc) pour décrypter in vivo, au niveau des cellules gonadotropes, les mécanismes moléculaires et épigénétiques qui sous-tendent leur plasticité dans des conditions physiologiques (cycle œstral) et pathologiques (obésité induite par l’alimentation). L’analyse bio-informatique de ces données est réalisée en collaboration avec O. Taboureau (équipe 8).
L’Hôte (PI), G. Garrel, J. Cohen-Tannoudji. Collaborations: O. Taboureau & N. Cerisier, (BFA Equipe 6), Funding: IDEX Emergence grant.
Plasticité de la signalisation œstrogénique au sein de l’axe gonadotrope
L’E2 joue un rôle essentiel dans la fertilité féminine, en régulant localement la fonction ovarienne et en exerçant des rétroactions négatives et positives sur l’axe hypothalamo-hypophysaire. Les actions de l’E2 sont principalement médiées par les récepteurs des œstrogènes ERα et ERβ, qui induisent, après homo ou hétérodimérisation, une signalisation génomique et non génomique. ERβ est principalement exprimé dans les cellules de la granulosa (GC) des follicules ovariens et contribue à la régulation de la croissance et de la maturation des follicules. Il a été très récemment rapporté que ERβ est exprimé, avec ERα, dans la pituitaire humaine (Zhang et al. Cell Rep, 2022). L’objectif principal de notre projet de recherche est d’identifier les rôles et les mécanismes de signalisation d’ERβ dans les deux organes, qui sont loin d’être entièrement compris. Cinq isoformes épissées de ERβ humain ont été caractérisées, appelées ERβ1-5. Nous avons récemment montré que ERβ1, ERβ2, ERβ4, et ERβ5 sont fortement exprimés dans la CG humaine des follicules ovulatoires, avec certaines isoformes mais pas toutes régulant la croissance cellulaire (Pierre, et al. International Journal of Molecular Sciences, 2021 ; Chauvin et al. Journal of Molecular Sciences, 2022). Notre projet s’appuie sur trois objectifs majeurs pour décrypter : i) comment l’E2 régule la croissance et la maturation des follicules à travers ses différentes isoformes ERβ, ii) les altérations potentielles de la signalisation de l’E2 dans les troubles ovariens comme dans le SOPK, principale cause d’infertilité féminine, et iii) le rôle de chaque membre de l’ER dans le contrôle des fonctions hypophysaires. Dans l’ensemble, notre projet devrait permettre de déchiffrer les rôles spécifiques des isoformes ERβ dans le déclenchement des diverses actions de l’E2 dans l’ovaire et l’hypophyse humains, et d’apporter de nouveaux éclairages sur les altérations moléculaires survenant au cours des infertilités.
S. Chauvin (PI), L’Hôte et collaborateurs : Pr Grynberg & Pr Frydman (Hôp. A. Béclère, Clamart); Pr C. Touboul & Dr A. Crestani (Hôp. Tenon, Paris 20); P. Tuffery & S. Murail (BFA, Team 7).
Axes Thématiques Transversaux
Rôle de la signalisation de l’estradiol dans la plasticité des cellules β du pancréas
L’estradiol (E2) joue un rôle crucial dans l’homéostasie du glucose et le métabolisme énergétique, en protégeant la fonction et la survie des cellules β des îlots pancréatiques. En conséquence, les modèles animaux de DT2 montrent un dimorphisme sexuel avec une protection relative chez les femelles, et les données cliniques associent la carence en œstrogènes de la ménopause à un risque accru de diabète. Les cellules β humaines et des rongeurs expriment deux récepteurs de l’estradiol (ERa et ERβ). L’effet insulinotrope rapide de l’E2 semble principalement médié par ERβ, tandis que la biosynthèse de l’insuline nécessiterait l’action génomique d’ERa. Cependant, les mécanismes moléculaires de l’action de l’E2 dans les cellules β humaines restent mal compris, en particulier en lien avec le diabète.
Dans ce projet, nous cherchons à explorer l’impact de la signalisation E2 sur la croissance et la fonction des cellules β. Pour cela nous analysons l’expression des récepteurs d’estradiol, en particulier les isoformes ERβ humaines, dans des îlots pancréatiques provenant de donneurs masculins et féminins (collaboration avec le Dr P. Cattan, Hôp. Saint-Louis). À l’aide de techniques lentivirales et de RNAseq, nous évaluons le rôle de chaque récepteur dans la sécrétion d’insuline stimulée par l’E2, à partir de cellules β exposées à des concentrations d’E2 reflétant les variations hormonales au cours de la vie (puberté, ménopause). Enfin, l’étude de la signalisation des récepteurs d’estradiol dans un modèle animal diabétique (rats GK) permettra de comprendre comment les altérations de cette signalisation qui pourraient contribuer à la dégradation des cellules β et au développement du diabète.
- Chauvin (PI), C. Tourrel-Cuzin (PI), J. Movassat , S. Tolu. Collaborators: P. Cattan and M. Armanet (Hôp. Saint Louis, Paris 10).
Vulnérabilité des cellules hypophysaires et gonadotropes à l’exposition prénatale à un environnement diabétique.
Le concept des origines développementales de la santé et de la maladie (DoHAD), décrit comment les perturbations de l’environnement fœtal, peuvent altérer la programmation épigénétique des fonctions physiologiques, contribuant au développement de maladies à l’âge adulte. Le diabète gestationnel (DG) en est un exemple, étant associé à un risque accru de maladies métaboliques, cardiovasculaires, neurodéveloppementales et reproductrices chez les descendants (Portha et al. Nutrients, 2019). Des études sur des modèles animaux montrent également qu’une hyperglycémie chronique peut perturber l’épigénome des cellules gonadotropes hypophysaires, affectant la fonction reproductive (Feldman et al. FASEB, 2019; Bourgneuf et al. Nat Comm, 2021).
Ce projet a pour objectif d’étudier, pour la première fois, la vulnérabilité épigénétique des cellules gonadotropes hypophysaires in vivo dans le contexte d’un DG léger, en utilisant le modèle de rat GK, qui n’est pas uniquement un modèle de DT2, car il présente des caractéristiques de DG. Ce projet a pour but: 1/ d’analyser les modifications épigénétiques et transcriptionnelles dans l’hypophyse des rats GK à différents stades de leur vie reproductive, en combinant approches ciblées et multi-omiques, 2/ de distinguer les effets de l’environnement diabétique in utero de l’origine génétique, nous utilsons la technique de transferts d’embryons entre rattes Wistar et GK, 3/ de corriger les épimutations spécifiques liées au DG par une approche CRISPRi, afin de restaurer une fonction physiologique normale des gonadotropes et la fertilité. Ce projet pourrait offrira ainsi un éclairage nouveau sur les mécanismes épigénétiques affectant la fonction reproductive sous l’influence d’un déséquilibre métabolique gestationnel.
L’Hôte (PI), B. Uzan (PI), J. Movassat, J. Cohen-Tannoudji, G. Garrel. Collaborateurs : C. Racine et N. Diclemente (UMRS_938, Hôp. Saint-Antoine, Paris 12)
Publications
2025
Tolu S, Hamzé R, Moreau M, Bertrand R, Janel N, Movassat J. Beta cell function and global glucose metabolism are impaired in Dp(16)1Yey mouse model of Down syndrome. Diabetes Obes Metab. 2025 Jan 13.
Gautheron G, Péraldi-Roux S, Vaillé J, Belhadj S, Patyra A, Bayle M, Youl E, Omhmmed S, Guyot M, Cros G, Guichou JF, Uzan B, Movassat J, Quignard JF, Neasta J, Oiry C. The flavonoid resokaempferol improves insulin secretion from healthy and dysfunctional pancreatic β-cells. Br J Pharmacol. 2025 Jan;182(1):52-68.
2024
Guillemain G, Khemtemourian L, Brehat J, Morin D, Movassat J, Tourrel-Cuzin C, Lacapere JJ. TSPO in pancreatic beta cells and its possible involvement in type 2 diabetes. Biochimie. 2024 Sep;224:104-113.
Segú H, Jalševac F, Sierra-Cruz M, Feliu F, Movassat J, Rodríguez-Gallego E, Terra X, Pinent M, Ardévol A, Blay MT. Assessing the impact of insect protein sources on intestinal health and disease: insights from human ex vivo and rat in vivo models. Food Funct. 2024 Apr 22;15(8):4552-4563.
Le Ciclé C, Pacini V, Rama N, Tauszig-Delamasure S, Airaud É, Petit F, de Beco S, Cohen-Tannoudji J, L’Hôte D. Migration des cellules gonadotropes durant l’embryogenèse hypophysaire – Rôle des facteurs de transcription NEUROD1 et NEUROD4 [Transcription factors NEUROD1 and NEUROD4 in the migration of gonadotrope cells during pituitary embryogenesis]. Med Sci (Paris). 2024 Nov;40(11):810-812.
Actualités de l’Unité
Le rôle clé de la communication intestin-cerveau dans le circuit de la récompense

La théorie du vieillissement
La théorie du vieillissement par Michaël Reira. Epsiloon le magazine scientifique d’actualité

Un monde sous plastique, enquête sur une crise sanitaire et environnementale au 21è siècle
Retrouvez, via le lien ci dessous, les détails du cycle de 12 heures avec les coordinatrices Francelyne MARANO, Sonja BOLAND et Stéphanie DEVINEAU. Un monde sous plastique, enquête sur une crise sanitaire et environnementale au 21è siècle | Université Ouverte

