Dégénérescence, Neurotransmission, Stress et Vieillissement
Responsables de l’équipe: Serge Birman (CNRS), Véronique Monnier (UPCité)
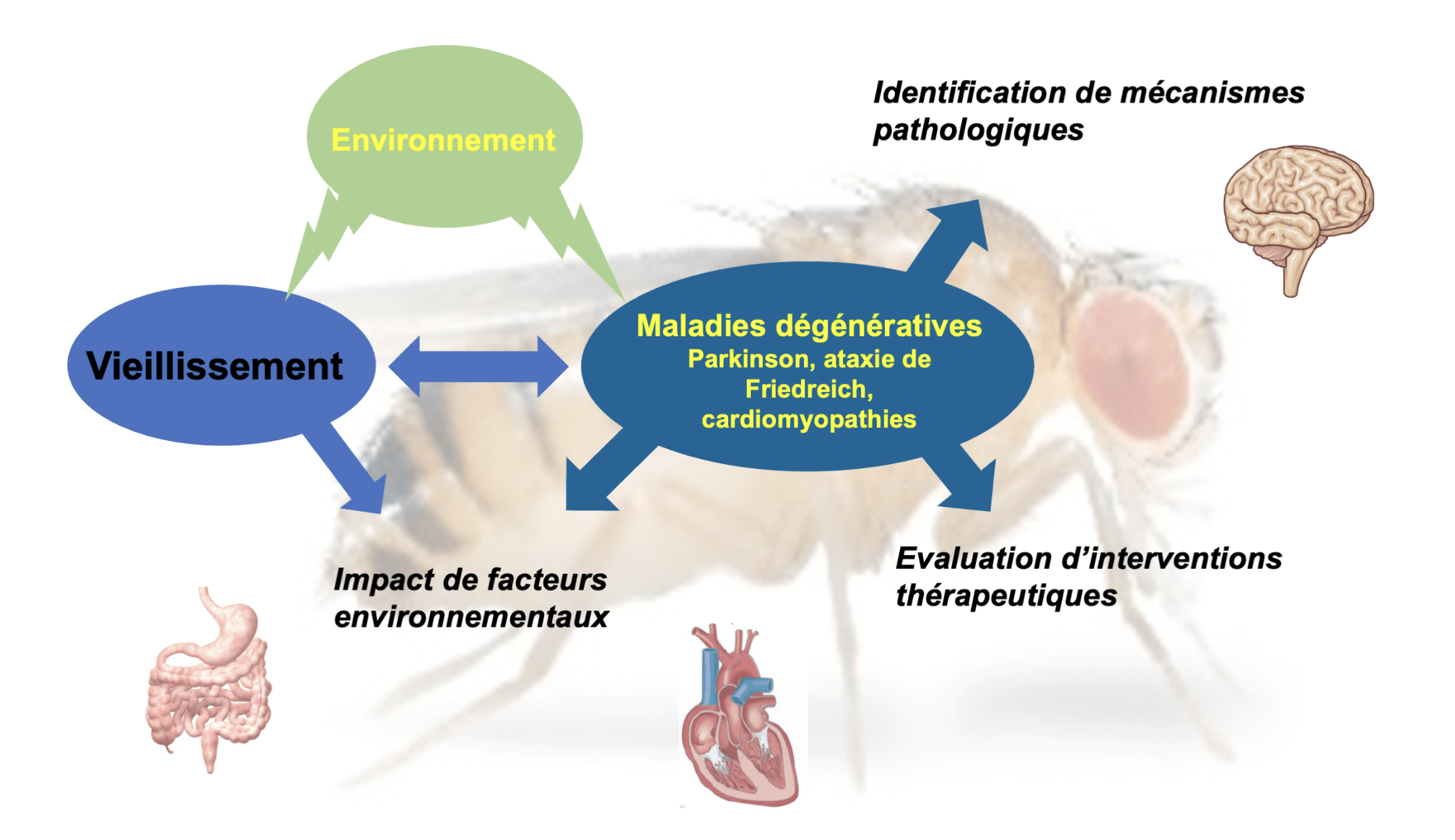
L’objectif central de notre équipe est d’étudier les processus génétiques, cellulaires et synaptiques impliqués dans le vieillissement et les troubles dégénératifs chez l’homme. Nous visons à identifier et caractériser les mécanismes et gènes impliqués, évaluer l’impact de facteurs environnementaux (alimentation, pesticides) et sur cette base, identifier de nouvelles interventions thérapeutiques. Nous utilisons la drosophile comme organisme modèle, ce qui nous permet de développer des approches intégratives multi-échelles et in vivo. Nos recherches portent en particulier sur deux maladies neurodégénératives : l’ataxie de Friedreich et la maladie de Parkinson. Pour ces deux pathologies, la principale caractéristique est la neurodégénérescence, mais d’autres organes sont également touchés, comme par exemple l’intestin pour la maladie de Parkinson, et le cœur pour l’ataxie de Friedreich.
© BFA, UMR 8251 CNRS – Université Paris Cité
Axes thématiques
Axe 1 : Physiopathologie des maladies neurodégénératives et des cardiomyopathies
Notre premier axe de recherche porte sur les aspects génétiques et cellulaires des dégénérescences affectant les systèmes nerveux et cardiaque. Pour l’étude de la maladie de Parkinson, nous nous intéressons à plusieurs gènes déjà connus pour être impliqués dans des formes familiales et sporadiques de la maladie (en particulier SNCA qui code pour l’α-synucléine, DJ-1 et LRRK2), dans le but de mieux comprendre comment ces gènes sont impliqués dans la progression de la pathologie et la dégénérescence des neurones dopaminergiques. Dans le cas de l’ataxie de Friedreich, la maladie est due à une diminution de l’expression de la frataxine, une protéine mitochondriale impliquée dans la biosynthèse des clusters fer-soufre (ISC). Nous étudions comment le déficit en frataxine impacte ce processus mitochondrial essentiel et entraine en conséquence de multiples dysfonctionnements cellulaires. Concernant les cardiomyopathies, notre objectif est d’utiliser la drosophile comme outil de validation de nouveaux gènes et mécanismes via le criblage fonctionnel de gènes candidats identifiés chez les patients.
Axe 2 : Evaluation de nouvelles interventions thérapeutiques in vivo
Cet axe est consacré à l’identification et à l’évaluation in vivo d’approches thérapeutiques, dans des modèles de la maladie de Parkinson et de l’ataxie de Friedreich chez la drosophile. Nous développons essentiellement deux types d’approches :
1) le criblage pharmacologique de molécules candidates, qui sont soit sélectionnées sur la base de leurs effet connus sur des processus affectés dans les pathologies qui nous intéressent (tels que le stress oxydant, des perturbations de la fonction mitochondriale ou de l’homéostasie du fer…) ou des molécules qui sont issues de criblage haut-débit sur des modèles in vitro ou in silico réalisés par nos collaborateurs
2) la recherche et l’évaluation de peptides thérapeutiques. Nous recherchons en particulier des peptides interférents qui permettent de déstabiliser des interactions entre deux protéines participant aux processus physiopathologiques. Cette partie bénéficie de l’expertise de l’équipe TMP2I de l’unité.
Axe 3 : Impact de facteurs environnementaux sur le vieillissement et les neurodégénérescences
Les conditions environnementales peuvent avoir un impact fort sur la longévité et les maladies neurodégénératives liées à l’âge. Nous nous y intéressons sous deux angles :
1) L’impact à long terme, maintenus sur plusieurs générations soit transgénérationnels, que peuvent avoir des variations de facteurs environnementaux sur le vieillissement de l’organisme
2) Les effets d’une exposition environnementale à des composés neurotoxiques. Un risque accru de développer la maladie de Parkinson a été observé en particulier chez les agriculteurs qui ont été exposées pendant une longue période à des pesticides. La drosophile est un organisme modèle particulièrement pertinent pour étudier le lien moléculaire entre l’exposition aux pesticides et la maladie de Parkinson.
Publications Récentes
Petitgas, C., Seugnet, L., Dulac, A., Matassi G., Mteyrek, A., Fima, R., Strehaiano, M., Dagorret, J., Chérif-Zahar, B., Marie, S., Ceballos-Picot, I., Birman, S. (2024) Metabolic and neurobehavioral disturbances induced by purine recycling deficiency in Drosophila. eLife 12:RP88510. doi:10.7554/eLife.88510.3
Jullian E, Russi M, Turki E, Bouvelot M, Tixier L, Middendorp S, Martin E, Monnier V. Glial overexpression of Tspo extends lifespan and protects against frataxin deficiency in Drosophila. (2024) Biochimie. doi: 10.1016/j.biochi.2024.05.003
Mathas, N., Poncet, G., Laurent, C., Larigot, L., Le-Grand, B., Gonis, E., Birman, S., Galardon, E., Sari, M.-A., Tiouajni, M., Nioche, P., Barouki, R., Coumoul, X., Mansuy, D., Dairou, J. (2023) Inhibition by pesticides of the DJ-1/Park7 protein related to Parkinson disease. Toxicology 487:153467. doi:10.1016/j.tox.2023.153467
Rahmani, Z., Surabhi, S., Rojo-Cortés, F., Dulac, A., Jenny, A., Birman, S. (2022) Lamp1 deficiency enhances sensitivity to α-synuclein and oxidative stress in Drosophila models of Parkinson disease. Int. J. Mol. Sci. 23(21), 13078. doi:10.3390/ijms232113078
Ader F, Russi M, Tixier-Cardoso L, Jullian E, Martin E, Richard P, Villard E, Monnier V. Drosophila CRISPR/Cas9 mutants as tools to analyse cardiac filamin function and pathogenicity of human FLNC variants. (2022) Biol Open. bio059376. doi: 10.1242/bio.059376.
Dulac, A., Issa, A.-R., Sun, J., Matassi, G., Jonas, C., Rahmani, Z., Chérif-Zahar, B., Cattaert, D., Birman, S. (2021) A novel neuron-specific regulator of the V-ATPase in Drosophila. eNeuro 8(5):ENEURO.0193-21.2021. doi:10.1523/ENEURO.0193-21.2021
Martin E, Heidari R, Monnier V, Tricoire H. Genetic screen in adult Drosophila reveals that dCBP depletion in glial cells mitigates Huntington disease pathology through a Foxo-dependent pathway. (2021) Int J Mol Sci. 22(8):3884. doi: 10.3390/ijms22083884
Teseo S, Houot B, Yang K, Monnier V, Liu G, Tricoire H. G. sinense and P. notoginseng extracts improve healthspan of aging flies and provide protection in a Huntington disease model. (2021) Aging Dis. 12(2):425-440. doi: 10.14336/AD.2020.0714-1.
Actualités de l’équipe

Un monde sous plastique, enquête sur une crise sanitaire et environnementale au 21è siècle
Retrouvez, via le lien ci dessous, les détails du cycle de 12 heures avec les coordinatrices Francelyne MARANO, Sonja BOLAND et Stéphanie DEVINEAU. Un monde sous plastique, enquête sur une crise sanitaire et environnementale au 21è siècle | Université Ouverte

Du master au doctorat : l’expérience de Nejmeh (C2OFFEE) en Graduate School

Poste de maitre de conférence // BFA// UPCité
Le 19 septembre 2025, l’Unité de recherche BFA s’est retrouvée au Bateau Phare (Paris 13ᵉ) à l’occasion de sa journée scientifique annuelle.Cet événement a rassemblé l’ensemble des équipes de l’unité – IsPP, TPM2PI, DNSA, PMCX, REGLYS, C2OFFEE et EnDF – autour d’un...

Journée Scientifique BFA
Le 19 septembre 2025, l’Unité de recherche BFA s’est retrouvée au Bateau Phare (Paris 13ᵉ) à l’occasion de sa journée scientifique annuelle.Cet événement a rassemblé l’ensemble des équipes de l’unité – IsPP, TPM2PI, DNSA, PMCX, REGLYS, C2OFFEE et EnDF – autour d’un...
